View in English?
View in English?
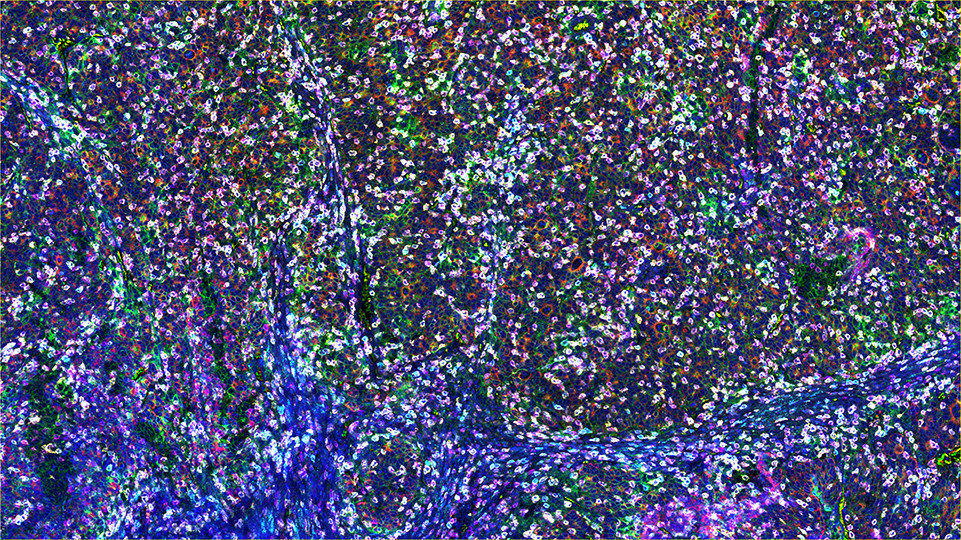 |
保存:キットのすべての構成品を-20°Cで保存してください。 安定性:キットのすべての構成品は、推奨された温度で保存した場合、少なくとも12 か月間安定性を維持します。5回を超える凍結/解凍サイクルは、行わないでください。 適用:SignalStarキットは、蛍光マルチプレックス免疫組織化学染色を行う際にご使用いただけます。 スライド数:このキットには、10枚のスライドの染色に必要な材料が含まれています。 |

SignalStarマルチプレックス免疫組織化学染色 (mIHC) は、抗体、オリゴヌクレオチド (オリゴ)、蛍光色素を使用して、細胞の存在、位置、機能、またバイオマーカーの共発現パターンを探索します。SignalStar技術は、空間的な配置と組織の構造を保持しつつ、複数の標的の表現型および機能を検出できます。細胞が、どのようにして組織化し、疾患進行や治療への応答を制御する組織の微小環境に影響を与えるかを理解するためには、これらの知見が不可欠です。
SignalStarシステムの能力の源は、SignalStarに用いる抗体のデザインに存在します。これらの抗体は、ホルマリン固定パラフィン包埋 (FFPE) 組織で用いるために厳密に検証されており、その後、部位特異的な標識と徹底した精製法を用いて各オリゴヌクレオチド (オリゴ) タグに結合させます。高度に特異的な、相補的なオリゴのネットワークと蛍光色素を用いることにより、科学者は、存在量が低いものも含めて3-8種類の標的のシグナルを増幅できます。
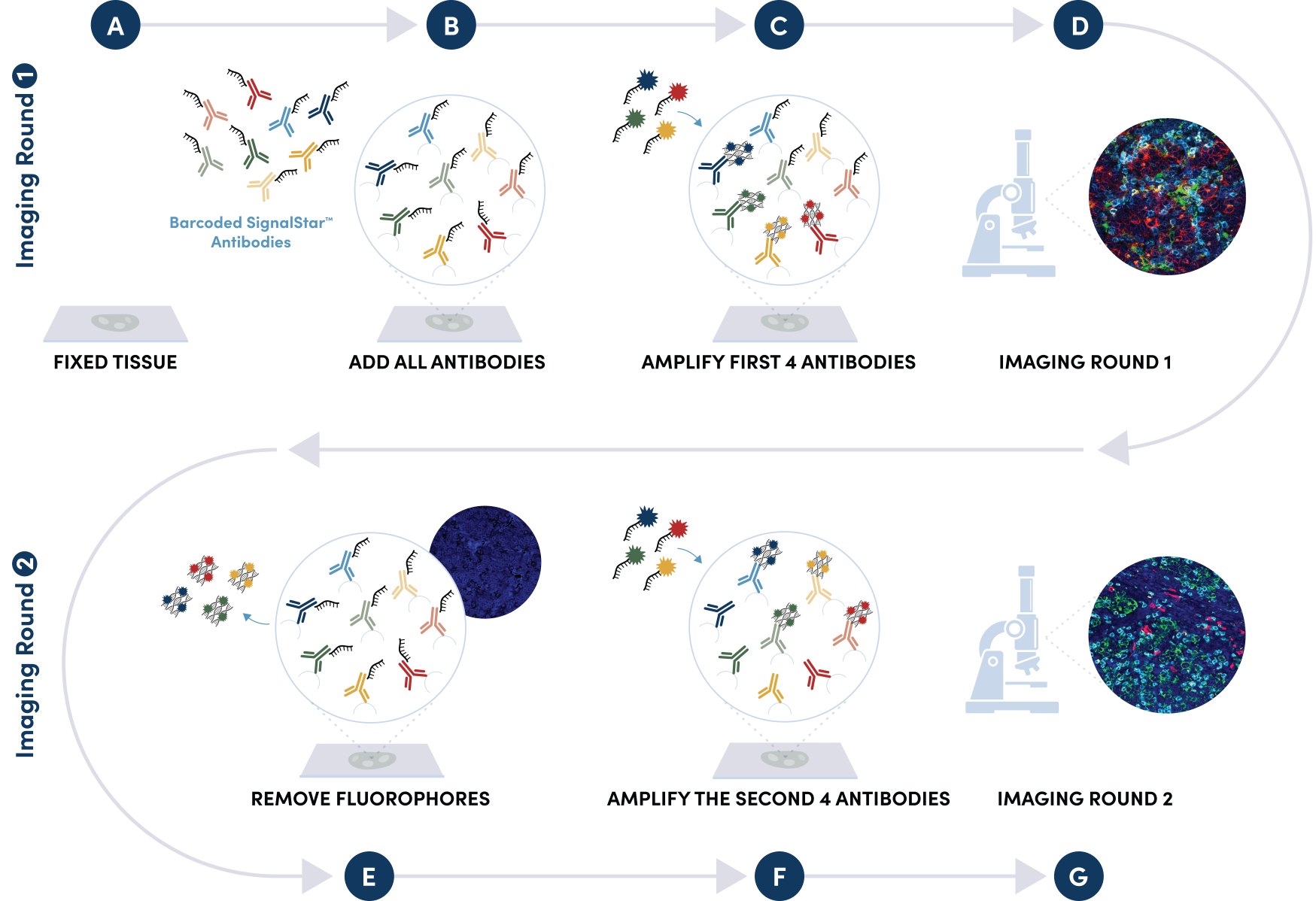
図 1: ご希望のプレックスサイズ (最大3-8種類のオリゴ標識抗体) のすべての抗体のカクテルを、1回の一次抗体インキュベーションステップの際に同時に添加します。蛍光色素標識済みの相補的なオリゴ (チャンネル:488、594、647、750) を用いて、オリゴ-蛍光色素のコンストラクトを構築して抗体に結合させることにより、1回目のイメージングラウンドで最大4種類のオリゴ標識抗体のシグナルが増幅できます。プレックスのサイズが4より大きい場合は、1ラウンド目のオリゴと蛍光色素分子を穏やかに除去し、2ラウンド目で、最大4種類の追加のオリゴ標識抗体を可視化するための増幅を行います。この相補的なオリゴシステムと蛍光色素の除去プロセスにより、交差反応を示すことなく、同じ基質を用いて2ラウンド目の抗体シグナルを増幅できます。その後、お手持ちの、または無料のソフトウェアを用いて、コンピューター上で2つの画像を結合し、最大8種類の標的で構成される画像を作成することができます。
| キットに含まれる材料 |
| 最大8種類のSignalStarオリゴ標識抗体 (以下を参照) |
| 最大8種類のSignalStar相補的オリゴ (以下を参照) |
| SignalStar™ Antibody Diluent A |
| SignalStar™ Antibody Diluent B |
| SignalStar™ Amplification Buffer A |
| SignalStar™ Amplification Buffer B |
| SignalStar™ Amplification Oligo Set A: |
| 488 |
| 594 |
| 647 |
| 750 |
| SignalStar™ Amplification Oligo Set B: |
| 488 |
| 594 |
| 647 |
| 750 |
| SignalStar™ Ligation Buffer |
| T4 DNA Ligase (5 U/µL) |
| ATP (100 mM) |
| 10X dsDNase Buffer |
| dsDNase |
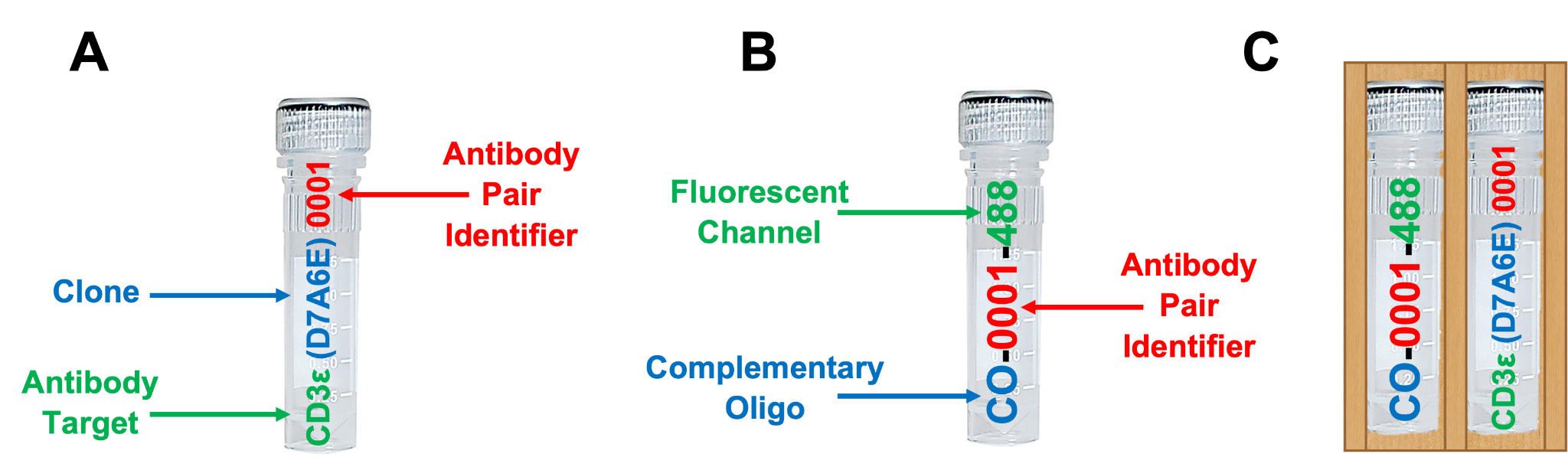
キットには、ご注文時にお選びいただいた最大8種類のSignalStarオリゴ標識抗体 (A) および最大8種類のSignalStar相補的オリゴ (B) が含まれており、これらはオリゴ-抗体ペア (C) として共に梱包されています。以下の例をご参照ください。
 |
同じチャンネルの相補的なオリゴを組み合わせないでください。1回のイメージングラウンドに含めることができる、各蛍光チャンネルの相補的なオリゴは1つのみです。同じイメージングラウンドで同じ蛍光チャンネルに特異的な相補的なオリゴを組み合わせると、アッセイの結果が解釈不能になる可能性があります。 |
|||||||||||||||||||||||||
 |
||||||||||||||||||||||||||
 |
異なるパネルの抗体を組み合わせないでください。 同時に複数のパネルを実行する場合は、パネルごとに個別の抗体/相補的なオリゴの混合物を作成する必要があります。 |
|||||||||||||||||||||||||
 |
溶液の作成前に、BOND RXソフトウェアを用いてプロトコールと試薬の設定を行ってください。 コンテナやプロトコール、新しいBOND Research Detection Systemを作成してください。このプロトコールの実行には、BOND Research Detection Systemが必要です。 |
|||||||||||||||||||||||||
 |
SignalStarアッセイの各ラウンドが完了したら、毎回BOND RXの吸引プローブの洗浄を行ってください。 |
|||||||||||||||||||||||||
 |
SignalStarパネルデザインが2ラウンドのイメージングを必要とするか否かを確認してください。 このページの10.1および9.1に記載しているSignalStarパネルデザインの例とSignalStarパネルデザインワークシートをお役立てください。 |
|||||||||||||||||||||||||
 |
使用を予定している顕微鏡が、このキットに含まれる蛍光色素を検出できるかを確認してください。 イメージングの際に、DAPIに加えて4蛍光チャンネルが必要になります。 |
|||||||||||||||||||||||||
|
||||||||||||||||||||||||||
 |
上記のスペクトルを用いて単一染色したスライドのイメージングによる、スペクトルライブラリーの作成を推奨します。 これにより、スペクトルの漏れ込みの最小化に役立つ、スペクトルの分離が可能になります。 |
|||||||||||||||||||||||||
 |
DAPIを含むマウント液ではなく、DAPI濃縮液の使用を推奨します。 明るいDAPI染色は、より良い画像の結合に役立ちます。 |
|||||||||||||||||||||||||
 |
溶液が十分に攪拌されていない場合、蛍光シグナルが変化する、または消失する可能性があります。 使用前に、各試薬を1,000 rpmで30秒間遠心し、その後、ゆっくりとピペッティングで混合してください。 試薬を使用する際は、正確性を確保するためにピペット操作をゆっくりと行ってください。使用時以外は、すべてのSignalStarキット構成品を氷上で保存してください。すべての試薬を混合したSignalStar溶液は、速やかに使用してください。 |
|||||||||||||||||||||||||
 |
可能な限り、染色が完了してから8時間以内にスライドのイメージングを行ってください。 この時間内にスライドのイメージングが行われない場合、蛍光シグナルが消失する可能性があります。 |
|||||||||||||||||||||||||
 |
このプロトコールからの逸脱がある場合、結果は保証できません。 SignalStarプロトコールは、指定された抗原除去と染色ステップに合わせて開発および最適化されています。 |
|||||||||||||||||||||||||
 |
ポジティブコントロールスライドの使用を推奨します。 マルチプレックスパネル内のすべての標的が存在することを発色染色で確認した組織を、各染色に含めることを推奨します。 |
|||||||||||||||||||||||||
 |
各抗体を1:100で使用することを推奨します。 ただし、1:50または1:200希釈のいずれかで使用した場合でも十分な量の抗体試薬を提供しています。 |
 |
溶液の作成前に、BOND RXソフトウェアを用いてプロトコールと試薬の設定を行ってください。BOND RXソフトウェアバージョン7.0以上が必要です。 |
以下の試薬は、SignalStarアッセイ用にBOND RXで作成する必要があります。
BONDタイトレーションコンテナ
|
1. MARKER (= SignalStar Staining Solution) |
|
|
2. SignalStar Amplification Solution 1 |
|
|
3. SignalStar Amplification Solution 2 |
|
|
4. SignalStar Ligation Solution |
|
|
5. SignalStar Fluorescent Removal Solution |
BOND 7 mLオープンコンテナ
|
6. 10%中性緩衝ホルマリン液 |
|
 |
10%中性緩衝ホルマリン液を作成する際は、「有害物」を選択し、廃液が適切に廃棄されることを確認してください。 |
BOND 30 mLオープンコンテナ
|
7. 0.1X TBST |
|
|
8. 1X TBST (BOND Research Detection Systemへの連結に必要です) |
|
1. 「CST SignalStar」と名付けた新しいBOND Research Detection Systemを作成してください。 |
|
|
2. 1X TBSTを用いて、30 mLオープンコンテナをCST SignalStar BOND Research Detection Systemに連結してください。 |
|
 |
ステップ2のオープンコンテナには明確な名称をつけてください (例えば「0.1X TBST」ではなく「1X TBST」)。 |
|
1. BOND RXソフトウェアで、「プロトコール設定」を選択してください。 |
||||
|
2. 「*IF Protocol」を選択してください。(「更新者」カラムにLeicaが表示されていることを確認してください。) |
||||
|
3. プロトコールをコピーして作成し、「CST SignalStar イメージングラウンド1」に名称を変更してください。省略名の「CST Rd1」を追加してください。 |
||||
|
4. 「洗浄ステップの表示」を選択してください。 |
||||
|
|
|||
|
6. 適合検出システムは「CST SignalStar」を選択してください。 |
||||
|
7. 「プロトコール作成」を選択してください。 |
||||
|
8. 注意書きに同意するため、「保存」と「はい」をクリックしてください。 |
||||
|
9. 「CST SignalStarイメージングラウンド1」プロトコールのコピーを作成してください。 |
||||
|
10. コピーのファイル名を「CST SignalStarイメージングラウンド2」に変更し、省略名「CST Rd2」を追加してください。 |
||||
|
11. 「洗浄ステップの表示」を選択してください。 |
||||
|
||||
|
13. 適合検出システムは「CST SignalStar」を選択してください。 |
||||
|
14. 「プロトコール作成」を選択してください。 |
||||
|
15. 注意書きに同意するため、「保存」と「はい」をクリックしてください。 |
 |
アッセイを正しく実行するために、各試薬は適切なBOND RXコンテナ中か、BOND Titration Kit (#OPT9049) のインサート中で使用する必要があります。 BOND RX自動染色装置でSignalStarアッセイを行うために必要なコンテナまたはインサートの数は下表をご覧ください。 |
||||||||||||||||||||||||||||||||||
 |
オープンコンテナを過充填しないでください。BOND RX自動染色装置は、コンテナが過充填されていると「Empty」とみなします。 |
||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||
 |
調製後の溶液は、キットのご注文時にお選びいただいたすべての抗体 (イメージングラウンド1とイメージングラウンド2を合わせて最大8種類) と、イメージングラウンド1の相補的なオリゴが含まれている必要があります。このページの10.1および9.1に記載しているSignalStarパネルデザインの例とSignalStarパネルデザインワークシートをお役立てください。 |
||||||||||||||||||||||||||||||||||||||||||||||||||
 |
同じ蛍光チャンネルの相補的なオリゴを組み合わせないでください。 |
||||||||||||||||||||||||||||||||||||||||||||||||||
 |
低吸着ピペットチップを用いてすべてのSignalStarキット構成品を混合し、室温で20分間、ローテーターで転倒混和してください。正確性を確保し、気泡の発生を防ぐために、BOND 6 mLタイトレーションインサート中ではゆっくりとピペッティングしてください。溶液を調製する際は、すべてのSignalStarキット構成品を氷上に保存してください。すべての試薬を混合したSignalStar溶液は、速やかに使用してください。 |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
 |
低吸着ピペットチップを用いてすべてのSignalStarキット構成品を混合し、室温で20分間、ローテーターで転倒混和してください。正確性を確保し、気泡の発生を防ぐために、BOND 6 mLタイトレーションインサート中ではゆっくりとピペッティングしてください。溶液を調製する際は、すべてのSignalStarキット構成品を氷上に保存してください。すべての試薬を混合したSignalStar溶液は、速やかに使用してください。 |
||||||||||||||||||||||||||
 |
10スライドを実行する際は、まずコニカルチューブ内で総量を作成し、20分間ローテーターで混合した後、2つのタイトレーションインサート間で均等に分注してください。 |
||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
 |
低吸着ピペットチップを用いてすべてのSignalStarキット構成品を混合し、室温で20分間、ローテーターで転倒混和してください。正確性を確保し、気泡の発生を防ぐために、BOND 6 mLタイトレーションインサート中ではゆっくりとピペッティングしてください。溶液を調製する際は、すべてのSignalStarキット構成品を氷上に保存してください。すべての試薬を混合したSignalStar溶液は、速やかに使用してください。 |
||||||||||||||||||||||||||
 |
10スライドを実行する際は、まずコニカルチューブ内で総量を作成し、20分間ローテーターで混合した後、2つのタイトレーションインサート間で均等に分注してください。 |
||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
 |
以下の試薬を、1つのBONDタイトレーションインサート中で混合してください。パラフィルムで蓋をし、10秒間ボルテックスしてください。溶液を調製する際は、すべてのSignalStarキット構成品を氷上に保存してください。すべての試薬を混合したSignalStar溶液は、速やかに使用してください。 |
||||||||||||||||||||
|
|||||||||||||||||||||
|
 |
スライドベーキングは、実験開始の前日に行うことができます。このステップで、パラフィンワックスを融解させます。 |
| 1. スライドを60°Cで30分間インキュベートしてください。 |
| 2. BOND RXソフトウェア上で新たな実験を作成し、スライドを追加してください。 | |
3. 「スライドを追加」する際に、BOND上での組織の調製用に、以下を選択してください。
|
|
| 4. 各スライドについて、プロトコール欄で「SignalStarイメージングラウンド1」と「HIER ER2 40 min」を選択してください。 | |
| 5. ラベルを印刷してスライドに貼り、そのスライドをBONDスライドトレーに設置してください。 | |
| 6. BONDカバータイルをスライド上に置き、トレーの適切な位置に設置されていることを確認してください。 | |
 |
SignalStarイメージングラウンド1プロトコールの各ステップが正しく実行されていることを確認することは重要です。 セクション 9.2に記載しているチェックリストを、プロトコールの作成にお役立てください。 |
 |
以下の各0.1X TBST洗浄ステップが「オープン」にセットされていることを確認してください。 もし洗浄ステップが「オープン」でない場合には、蛍光シグナルが変化または消失する可能性があります。6回のSignalStar Amplification Solution 1ステップおよび6回のSignalStar Amplification Solution の合計2ステップがあることを確認してください。 |
 |
バルクBond Wash Solutionコンテナが充填されており、廃液コンテナが空であることを確認してください。 |
| 7. BOND RXを実行してください。 | |
 |
速やかにBOND RX染色実行を開始し、遅延スタートは使用しないでください。染色が完了後、スライドをBOND RX自動染色装置上に一晩置いておくことができます。 |
| 8. BOND RX自動染色装置からスライドを取り出して、0.1X TBSTに浸してください。 | |
| 9. BOND RX自動染色装置上の吸引プローブ洗浄を実行してください。毎回、カバータイルを洗浄してください。 | |
| 10. データシートの指示に従って、DAPI #4083溶液を調製してください。 | |
| 11. DAPI溶液で対比染色してください。 | |
| 12. スライドを0.1X TBST中に30秒間浸してください。 | |
| 13. スライドをProLong Gold Antifade Reagent #9071でマウントしてください。 | |
| 14. 8時間以内にスライドのイメージングを行ってください。 | |
 |
脱パラフィン後、またはカバースリップを取り外す際は、どの時点でもスライドを乾燥させないようにしてください。 |
 |
アッセイを正しく実行するために、各試薬は適切なBOND RXコンテナ中か、BOND Titration Kit (#OPT9049) のインサート中で使用する必要があります。 BOND RX自動染色装置でSignalStarアッセイを行うために必要なコンテナまたはインサートの数は下表をご覧ください。 |
||||||||||||||||||||||||||||||||||||||
 |
オープンコンテナを過充填しないでください。BOND RX自動染色装置は、コンテナが過充填されていると「Empty」とみなします。 |
||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||
 |
調製後のSignalStarイメージングラウンド2溶液は、イメージングラウンド2用の相補的なオリゴを含んでいる必要があります。このページの10.1および9.1に記載しているSignalStarパネルデザインの例とSignalStarパネルデザインワークシートをお役立てください。 |
||||||||||||||||||||||||||
 |
同じ蛍光チャンネルの相補的なオリゴを組み合わせないでください。 |
||||||||||||||||||||||||||
 |
低吸着ピペットチップを用いてすべてのSignalStarキット構成品を混合し、室温で20分間、ローテーターで転倒混和してください。正確性を確保し、気泡の発生を防ぐために、BOND 6 mLタイトレーションインサート中ではゆっくりとピペッティングしてください。溶液を調製する際は、すべてのSignalStarキット構成品を氷上に保存してください。すべての試薬を混合したSignalStar溶液は、速やかに使用してください。 |
||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
 |
低吸着ピペットチップを用いてすべてのSignalStarキット構成品を混合し、室温で20分間、ローテーターで転倒混和してください。正確性を確保し、気泡の発生を防ぐために、BOND 6 mLタイトレーションインサート中ではゆっくりとピペッティングしてください。溶液を調製する際は、すべてのSignalStarキット構成品を氷上に保存してください。すべての試薬を混合したSignalStar溶液は、速やかに使用してください。 |
||||||||||||||||||||||||||
 |
10スライドを実行する際は、まずコニカルチューブ内で総量を作成し、20分間ローテーターで混合した後、2つのタイトレーションインサート間で均等に分注してください。 |
||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
 |
低吸着ピペットチップを用いてすべてのSignalStarキット構成品を混合し、室温で20分間、ローテーターで転倒混和してください。正確性を確保し、気泡の発生を防ぐために、BOND 6 mLタイトレーションインサート中ではゆっくりとピペッティングしてください。溶液を調製する際は、すべてのSignalStarキット構成品を氷上に保存してください。すべての試薬を混合したSignalStar溶液は、速やかに使用してください。 |
||||||||||||||||||||||||||
 |
10スライドを実行する際は、まずコニカルチューブ内で総量を作成し、20分間ローテーターで混合した後、2つのタイトレーションインサート間で均等に分注してください。 |
||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
 |
1つのBONDタイトレーションインサート中で以下の試薬を混合してください。パラフィルムで蓋をし、10秒間ボルテックスしてください。溶液を調製する際は、すべてのSignalStarキット構成品を氷上に保存してください。すべての試薬を混合したSignalStar溶液は、速やかに使用してください。 |
||||||||||||||||||||
|
|||||||||||||||||||||
 |
1つのBONDタイトレーションインサート中で以下の試薬を混合してください。パラフィルムで蓋をし、10秒間ボルテックスしてください。溶液を調製する際は、すべてのSignalStarキット構成品を氷上に保存してください。すべての試薬を混合したSignalStar溶液は、速やかに使用してください。 |
|||||||||||||||||
|
||||||||||||||||||
|
| 1. SignalStarイメージングラウンド1のイメージング後に、スライドをdH2O中に30分間以上浸してからカバースリップを穏やかに除去してください。 | |
 |
脱パラフィン後、またはカバースリップを取り外す際は、どの時点でもスライドを乾燥させないようにしてください。 |
| 2. BOND RXソフトウェア上で新たな実験を作成し、スライドを追加してください。 | |
3. 「スライドを追加」する際に、BOND上での組織の調製用に、以下を選択してください。
|
|
| 4. 「SignalStarイメージングラウンド 2」を選択して、スライド調製と加熱処理で「--」が選択されていることを確認してください。 | |
| 5. ラベルを印刷してスライドに貼って、そのスライドをBONDスライドトレーに設置してください。 | |
| 6. BONDカバータイルをのせる前に、2-3 滴のdH2Oを各スライド上に添加してください。 | |
 |
重要:Dewaxおよび加熱処理 (抗原賦活化) は、増幅ラウンド2には必要ありません。Dewaxおよび加熱処理を行った場合、増幅ラウンド2の結果が解釈不能になる可能性があります。 |
 |
SignalStarイメージングラウンド2プロトコールの各ステップが正しく実行されていることを確認することは重要です。 セクション 9.3に記載しているチェックリストを、プロトコールの作成にお役立てください。 |
 |
以下の各0.1X TBST洗浄ステップが「オープン」にセットされていることを確認してください。もし洗浄ステップが「オープン」でない場合には、蛍光シグナルが変化または消失する可能性があります。6回のSignalStar Amplification Solution 1ステップおよび6回のSignalStar Amplification Solutionの合計2ステップがあることを確認してください。 |
 |
バルクBond Wash Solutionコンテナが充填されており、廃液コンテナが空であることを確認してください。 |
| 7. BOND RX実行を開始してください。 | |
 |
速やかにBOND RX染色実行を開始し、遅延スタートは使用しないでください。染色が完了後、スライドをBOND RX自動染色装置上に一晩置いておくことができます。 |
| 8. BOND RX自動染色装置からスライドを取り出して、0.1X TBSTに浸してください。 | |
| 9. BOND RX自動染色装置上の吸引プローブ洗浄を実行してください。毎回、カバータイルを洗浄してください。 | |
| 10. データシートの指示に従って、DAPI #4083溶液を調製してください。 | |
| 11. DAPI溶液で対比染色してください。 | |
| 12. スライドを0.1X TBST中に30秒間浸してください。 | |
| 13. スライドをProLong Gold Antifade Reagent #9071でマウントしてください。 | |
| 14. 8時間以内にスライドのイメージングを行ってください。 | |
 |
脱パラフィン後、またはカバースリップを取り外す際は、どの時点でもスライドを乾燥させないようにしてください。 |
| オリゴ標識抗体 | 相補的オリゴ | 製品ペア# | イメージングラウンド | 488 | 594 | 647 | 750 |
(付録10.1でパネルデザインの例をご覧ください。)
| BONDステップ | ✓ | 試薬 | ステップの種類 | インキュベーション時間 | 温度 (℃) | 分注量 |
| 1 | ☐ | *脱イオン化水 | 洗浄 | 0:00 | 室温 | 150 µL |
| 2 | ☐ | *脱イオン化水 | 洗浄 | 0:00 | 室温 | オープン |
| 3 | ☐ | *脱イオン化水 | 洗浄 | 0:00 | 室温 | 150 µL |
| 4 | ☐ | 0.1X TBST Solution | 洗浄 | 0:00 | 室温 | 150 µL |
| 5 | ☐ | MARKER (SignalStar Imaging Round 1 Solution) | 一次 | 40:00分 | 室温 | 150 µL |
| 6 | ☐ | 1X TBST Solution | 試薬 | 5:00分 | 室温 | オープン |
| 7 | ☐ | 0.1X TBST Solution | 試薬 | 5:00分 | 室温 | 150 µL |
| 8 | ☐ | 10%中性緩衝ホルマリン液 | 試薬 | 5:00分 | 室温 | 150 µL |
| 9 | ☐ | *脱イオン化水 | 洗浄 | 0:00 | 室温 | オープン |
| 10 | ☐ | *脱イオン化水 | 洗浄 | 0:00 | 室温 | オープン |
| 11 | ☐ | *脱イオン化水 | 洗浄 | 0:00 | 室温 | 150 µL |
| 12 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 13 | ☐ | SignalStar Amplification Solution 1 | 試薬 | 8:00分 | 室温 | 150 µL |
| 14 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 15 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 16 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 17 | ☐ | SignalStar Amplification Solution 2 | 試薬 | 16:00分 | 室温 | 150 µL |
| 18 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 19 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 20 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 21 | ☐ | SignalStar Amplification Solution 1 | 試薬 | 8:00分 | 室温 | 150 µL |
| 22 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 23 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 24 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 25 | ☐ | SignalStar Amplification Solution 2 | 試薬 | 16:00分 | 室温 | 150 µL |
| 26 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 27 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 28 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 29 | ☐ | SignalStar Amplification Solution 1 | 試薬 | 8:00分 | 室温 | 150 µL |
| 30 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 31 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 32 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 33 | ☐ | SignalStar Amplification Solution 2 | 試薬 | 16:00分 | 室温 | 150 µL |
| 34 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 35 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 36 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 37 | ☐ | SignalStar Amplification Solution 1 | 試薬 | 8:00分 | 室温 | 150 µL |
| 38 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 39 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 40 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 41 | ☐ | SignalStar Amplification Solution 2 | 試薬 | 16:00分 | 室温 | 150 µL |
| 42 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 43 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 44 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 45 | ☐ | SignalStar Amplification Solution 1 | 試薬 | 8:00分 | 室温 | 150 µL |
| 46 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 47 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 48 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 49 | ☐ | SignalStar Amplification Solution 2 | 試薬 | 16:00分 | 室温 | 150 µL |
| 50 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 51 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 52 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 53 | ☐ | SignalStar Amplification Solution 1 | 試薬 | 8:00分 | 室温 | 150 µL |
| 54 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 55 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 56 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 57 | ☐ | SignalStar Amplification Solution 2 | 試薬 | 16:00分 | 室温 | 150 µL |
| 58 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 59 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 60 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 61 | ☐ | SignalStar Ligation Solution | 試薬 | 20:00分 | 室温 | 150 µL |
| 62 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 63 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 64 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 65 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 66 | ☐ | BOND Wash Solution | 洗浄 | 0:00 | 室温 | 150 µL |
| BONDステップ | ✓ | 試薬 | ステップの種類 | インキュベーション時間 | 温度 (℃) | 分注量 |
| 1 | ☐ | 0.1X TBST Solution | 洗浄 | 0:00 | 室温 | オープン |
| 2 | ☐ | 0.1X TBST Solution | 洗浄 | 0:00 | 室温 | オープン |
| 3 | ☐ | SignalStar Stripping Buffer | 試薬 | 60:00分 | 37° | 150 µL |
| 4 | ☐ | SignalStar Stripping Buffer | 試薬 | 60:00分 | 37° | 150 µL |
| 5 | ☐ | *脱イオン化水 | 洗浄 | 0:00 | 室温 | オープン |
| 6 | ☐ | *脱イオン化水 | 洗浄 | 0:00 | 室温 | オープン |
| 7 | ☐ | *脱イオン化水 | 洗浄 | 0:00 | 室温 | オープン |
| 8 | ☐ | MARKER (SignalStar Imaging Round 2 Solution) | 一次 | 40:00分 | 室温 | 150 µL |
| 9 | ☐ | 1X TBST Solution | 試薬 | 5:00分 | 室温 | オープン |
| 10 | ☐ | 0.1X TBST Solution | 試薬 | 5:00分 | 室温 | オープン |
| 11 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 12 | ☐ | SignalStar Amplification Solution 1 | 試薬 | 8:00分 | 室温 | 150 µL |
| 13 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 14 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 15 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 16 | ☐ | SignalStar Amplification Solution 2 | 試薬 | 16:00分 | 室温 | 150 µL |
| 17 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 18 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 19 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 20 | ☐ | SignalStar Amplification Solution 1 | 試薬 | 8:00分 | 室温 | 150 µL |
| 21 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 22 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 23 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 24 | ☐ | SignalStar Amplification Solution 2 | 試薬 | 16:00分 | 室温 | 150 µL |
| 25 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 26 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 27 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 28 | ☐ | SignalStar Amplification Solution 1 | 試薬 | 8:00分 | 室温 | 150 µL |
| 29 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 30 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 31 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 32 | ☐ | SignalStar Amplification Solution 2 | 試薬 | 16:00分 | 室温 | 150 µL |
| 33 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 34 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 35 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 36 | ☐ | SignalStar Amplification Solution 1 | 試薬 | 8:00分 | 室温 | 150 µL |
| 37 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 38 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 39 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 40 | ☐ | SignalStar Amplification Solution 2 | 試薬 | 16:00分 | 室温 | 150 µL |
| 41 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 42 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 43 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 44 | ☐ | SignalStar Amplification Solution 1 | 試薬 | 8:00分 | 室温 | 150 µL |
| 45 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 46 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 47 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 48 | ☐ | SignalStar Amplification Solution 2 | 試薬 | 16:00分 | 室温 | 150 µL |
| 49 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 50 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 51 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 52 | ☐ | SignalStar Amplification Solution 1 | 試薬 | 8:00分 | 室温 | 150 µL |
| 53 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 54 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 55 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 56 | ☐ | SignalStar Amplification Solution 2 | 試薬 | 16:00分 | 室温 | 150 µL |
| 57 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 58 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 59 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 60 | ☐ | SignalStar Ligation Solution | 試薬 | 20:00分 | 室温 | 150 µL |
| 61 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 62 | ☐ | 0.1X TBST Solution | 試薬 | 0:00 | 室温 | オープン |
| 63 | BOND Wash Solution | 洗浄 | 0:00 | 室温 | 150 µL |
| オリゴ標識抗体 | 相補的オリゴ | 製品ペア# | イメージングラウンド | 488 | 594 | 647 | 750 |
| PD-1 (Intracellular Domain) (D4W2J) XP® Rabbit mAb (SignalStar™ Conjugate 0008) |
相補的オリゴ (CO-0008-488) |
17942 | 1 | ● | |||
| PD-L1 (E1L3N®) XP® Rabbit mAb (SignalStar™ Conjugate 0005) |
相補的オリゴ (CO-0005-594) |
28249 | 1 | ● | |||
| TIM-3 (D5D5R™) XP®Rabbit mAb (SignalStar™ Conjugate 0010) |
相補的オリゴ (CO-0010-647) |
15231 | 1 | ● | |||
| Ki-67 (8D5) Mouse mAb (SignalStar™ Conjugate 0014) |
相補的オリゴ (CO-0014-750) |
56398 | 1 | ● | |||
| CD8ɑ (D8A8Y) Rabbit mAb (SignalStar™ Conjugate 0004) |
相補的オリゴ (CO-0004-488) |
45747 | 2 | ● | |||
| CD68 (D4B9C) XP® Rabbit mAb (SignalStar™ Conjugate 0007) |
相補的オリゴ (CO-0007-594) |
77318 | 2 | ● | |||
| CD20 (E7B7T) XP® Rabbit mAb (SignalStar™ Conjugate 0011) |
相補的オリゴ (CO-0011-647) |
36775 | 2 | ● | |||
| Pan-Keratin (C11) Mouse mAb (SignalStar™ Conjugate 0003) |
相補的オリゴ (CO-0003-750) |
97227 | 2 | ● |
SignalStar Multiplex IHCのキットと試薬はどのように検証されていますか?
CSTは、SignalStar Multiplex IHCパネルビルダーでお選びいただける各抗体を入念に検証しています。また、イメージングの両ラウンドにおいて、タイトレーションや蛍光色素との組み合わせを通じて、抗体の様々な条件を試験しています。試験は、様々な腫瘍や組織を用いて行います。また、従来の発色アッセイに用いられる親抗体は、この蛍光アッセイの基礎となるため、厳密に試験されています。
このアッセイは凍結した組織で機能しますか?
SignalStar Multiplex IHCキットと試薬は、凍結された組織での使用に対してはまだ検証されていません。現在、新鮮組織または凍結組織で使用するための抗体とプロトコールを検証中です。
抗マウス抗体はありますか?
SignalStar Multiplex IHCのキットと試薬は、マウス組織での使用に対してはまだ検証されていません。現在、マウス反応性抗体を検証中です。
利用可能な抗体のリストに目的の標的が見当たりません。他の方法で手持ちのパネルに追加することができますか?
SignalStar Multiplex IHCキットと試薬は、メニューに含まれない抗体との使用に対してはまだ検証されていません。現在、SignalStar Multiplex IHCアッセイで、お手持ちの抗体を使用するためのカスタムソリューションを開発中です。
このアッセイに用いる抗体と直接標識を組み合わせることはできますか?
SignalStar Multiplex IHCのキットと試薬は、直接標識済み抗体と組み合わせての使用に対してはまだ検証されていません。直接標識済み抗体をプロトコールに取り入れることは可能であると考えられます。しかし、SignalStar試薬は、蛍光シグナルを増幅するという利点があるため、増幅されていない直接標識抗体と共に使用した際に、スペクトルの漏れ込みが発生する可能性があります。
連続切片のSignalStar染色を発色染色と比較すると、より多くの陽性細胞が見えます。この過剰な染色が正しいどうかを、どのように確認すれば良いですか?
最適化の過程で、蛍光染色は発色染色よりも高い陽性率を示す可能性があることが分かりました。過剰な染色が特異的であることを確認するには、細胞内局在や、他の染色と共局在性が正しいことを確認してください。例えば、すべてのCD8陽性細胞がCD3陽性である場合、発色染色と比較して過剰なCD8陽性細胞は、正しい染色である可能性が高くなります。
染色が完了してからスライドをイメージングするまで、どのぐらいの時間を置くことができますか?
1回目のイメージングラウンドは、染色完了後、最大8時間後までのイメージングにおいて強いシグナルを示すと考えられます。2回目のイメージングラウンドでは、イメージングは染色完了後に可能な限り速やかに行うべきですが、最大8時間後まではシグナルは強いと考えられます。
SignalStar Multiplex IHCのキットと試薬は、使用を予定している組織に対して最適化する必要がありますか?
SignalStar Multiplex IHCのキットと試薬は、蛍光色素の組み合わせと抗体の染色順について最適化されています。標的の特性と発現レベルは組織によって異なるため、パネル内の抗体濃度を2倍に増やす、または0.5倍に減らすなどの調整により実験で最適なシグナルを得ることができます。
このアッセイに含むべき適切なポジティブコントロールは何ですか?複数のコントロールが必要ですか?
各標的について、発色IHCで陽性であることことが示されたあらゆる組織が、ポジティブコントロール組織として機能します。標的ごとにポジティブコントロールが必要であるため、複数のコントロールが必要になる場合もあります。最適な比較を行うために、切片は可能な限り連続に近いものを用いてください。
For Research Use Only. Not for Use in Diagnostic Procedures.
Cell Signaling TechnologyXPおよびSignalStarは、Cell Signaling Technology, Inc.の商標です。
E1L3NはCell Signaling Technology, Inc.の登録商標です。CyおよびCyDyeはGE Healthcareの登録商標です。All other trademarks are the property of their respective owners. 商標情報のページをご覧ください。
© 2023 Cell Signaling Technology, Inc. All Rights Reserved.
更新:2023年7月