View in English?
View in English?
CSTのシグナル伝達パスウェイ図で個々のタンパク質名をクリックすると、それに関連した研究リソースや製品情報を検索することができます。さらに、教育・研究のために、パスウェイ図をダウンロードすることも可能です。
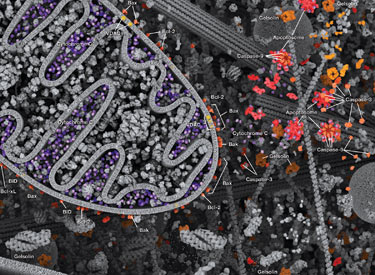
アポトーシスは厳密に制御された細胞死で、多細胞生物の定型的な成長・発達に必要です。不完全なアポトーシスは、発生異常および病態形成の原因となる可能性があります。
プログラムされたタンパク質分解カスケードにおいて、カスパーゼは特定のアミノ酸残基で標的タンパク質を切断します。アポトーシスシグナルはカスパーゼの活性化を誘発し、これには、大 (p20) および小 (p10) のカスパーゼドメインの切断とそれに続く再結合、そしてアミノ末端プロドメインの除去が関与します。哺乳動物のカスパーゼは、構造、分子機能、および基質選択性により分類されます。Caspase-2、 - 8、- 9、- 10、- 12は上流のアポトーシス促進シグナルに密接に連関しているので、「イニシエーターカスパーゼ」と呼ばれます。イニシエーターカスパーゼは、最終的にはプログラム細胞死を担うタンパク質を修飾する、下流エフェクターまたは「実行型」caspase-3、-6、-7を切断して活性化します。PARPおよびラミンA/Cのようなターゲットは、実行型カスパーゼにより切断され、アポトーシスのマーカーとして用いられます。カスパーゼは、アポトーシス阻害 (IAP) タンパク質 (c-IAP1/2、XIAP、livin、survivin) によって活性阻害を受け、それは直接結合、またはユビキチン介在性分解に至るカスパーゼを標的としたユビキチンリガーゼ作用によって行われます。IAPタンパク質とIAP阻害因子 (Smac/Diablo) との相互作用により、IAPが仲介するカスパーゼ阻害が解除され、アポトーシスが促進されます。
アポトーシスの内因性制御には、ミトコンドリアのシトクロムcの放出による細胞質カスパーゼの活性化が必要であるため、Bcl-2ファミリータンパク質によるミトコンドリア外膜の透過性の調節が関連しています。細胞死を促進するBcl-2ファミリータンパク質は、複数のBHドメイン (Bax、Bak)、または単一のBH3配列 (Bad、Bik、Bid、Puma、Bim、Bmf、Noxa) のいずれかを含みます。細胞生存を促進する複数のBHドメインを含むBcl-2ファミリータンパク質には、Bcl-2、Bcl-xL、Bcl-wがあります。アポトーシス促進性のBaxおよびBakは、ミトコンドリアでオリゴマー化し、膜透過性を変化させ、シトクロムcを細胞質に放出させます。抗アポトーシス性のBcl-xLは、膜結合性Baxに競合的に結合して、それらをミトコンドリア膜から引き離します。「BH3-only」タンパク質は、アポトーシスの重要な調節因子であり、抗アポトーシスタンパク質を阻害することでBaxおよびBakのミトコンドリア外膜への挿入を促進して細胞死を促進します。Bcl-2ファミリータンパク質は、リン酸化によってしばしば活性が制御されます。Badのリン酸化により、Bad、抗アポトーシス性のBcl-2、そしてBcl-xLタンパク質間の相互作用が阻害されます。アポトーシス促進性のBimのリン酸化により、Bimがユビキチン介在性に分解され、抗アポトーシスBcl-2およびBcl-xLタンパク質の阻害が軽減されます。DNA損傷に応答したBidのリン酸化により、その活性化が阻害され、DNAの修復および細胞生存経路が促進されます。
アポトーシスの外因性経路は、Fas、TNFαR、DR3、DR4、およびDR5などのデスレセプターがそれぞれのリガンドによって活性化されることで誘導されます。デスレセプターリガンドは、受容体をオリゴマー化することでシグナル伝達を開始する特徴があり、これにより特異的なアダプタータンパク質をリクルートし、カスパーゼカスケードを活性化します。FasLの結合により、アダプタータンパク質のFADDを介してイニシエーターのCaspase-8がリクルートされます。活性化されたCaspase-8は、2つの並行するカスケードを介してアポトーシスを促進します。すなわち、Caspase-3を直接切断して活性化するか、アポトーシス促進性のBcl-2ファミリータンパク質であるBidを切断します。切断されたBid (tBid) はミトコンドリアへ移動し、シトクロムc放出を誘導することで、Caspase-9とCaspase-3を順番に活性化します。